烟台海岸带所开发的新型“抗生素-抗菌肽”融合分子为耐药菌感染治疗带来新突破
随着抗生素耐药性的持续加剧,由生物膜引发的慢性及反复性感染日益普遍,耐药菌感染已成为全球公共卫生领域面临的一项重大挑战。作为临床治疗中“最后防线”之一的万古霉素,在应对万古霉素耐药金黄色葡萄球菌(VRSA)等耐药菌感染时,其疗效已显著受限。如何突破耐药菌与生物膜构成的双重防御屏障、拓展万古霉素对革兰氏阴性菌的抗菌活性,一直是抗感染研究领域亟待攻克的关键科学难题。近期,中国科学院烟台海岸带研究所动物资源与活性成分挖掘利用研究组(王义鹏研究团队),成功构建了一种新型抗菌融合分子Vm-MSI,为开发广谱、高效且低毒的新型抗感染策略提供了可行路径。
本研究采用简洁高效的化学偶联策略,将传统抗生素万古霉素与具有强效膜破坏能力的抗菌肽MSI-78(非洲爪蟾皮肤抗菌肽Magainin改造肽)共价连接,构建出具备双重作用机制的“抗生素-抗菌肽”融合分子(图1)。该融合分子兼具两类药物的优势:一方面保留了万古霉素对革兰氏阳性菌细胞壁靶点的高亲和力;另一方面借助MSI-78的膜穿透特性,获得了跨越革兰氏阴性菌外膜进入胞内的能力,从而显著扩展了万古霉素原有的抗菌谱。尤为重要的是,Vm-MSI的抗生物膜性能优异,在抑制生物膜形成与清除成熟生物膜方面,其效果均显著优于万古霉素或抗菌肽单独使用(图2)。
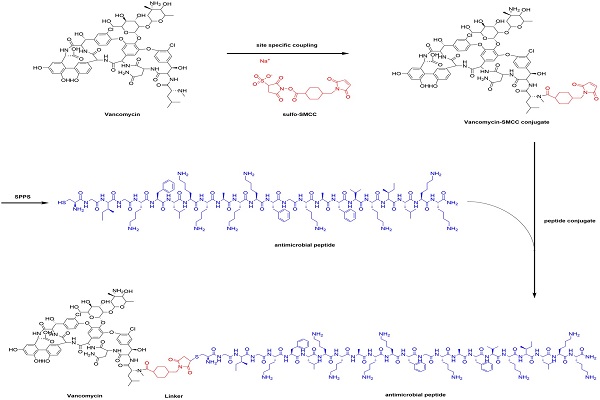
图1 万古霉素-抗菌肽偶联物的合成路线
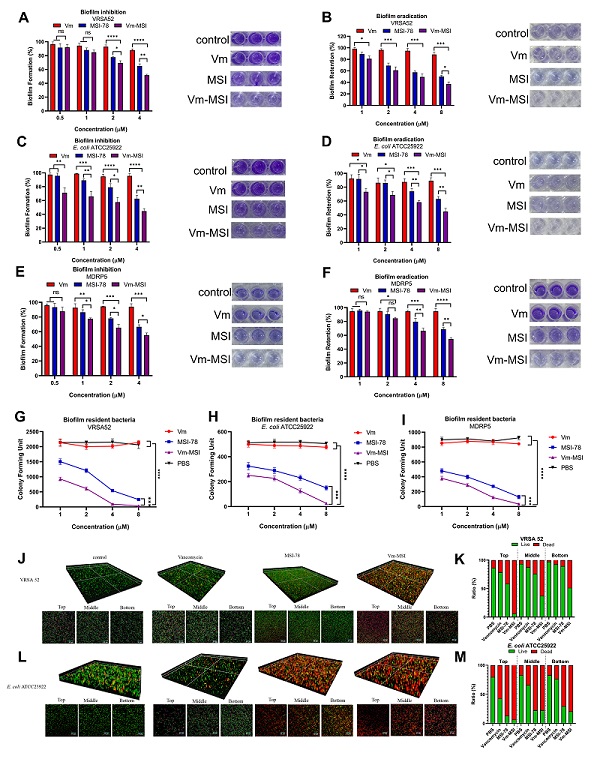
图2 Vm-MSI 展示了强大的抗生物膜活性
该融合分子在动物模型中亦展现出良好的治疗潜力。在VRSA诱导的皮肤感染小鼠模型中,Vm-MSI可有效降低创面细菌负荷,促进伤口愈合,并显著下调炎症因子水平(图3)。在多药耐药革兰氏阴性鲍曼不动杆菌诱导的小鼠肺部感染模型中,Vm-MSI同样可有效降低肺部细菌负荷,下调炎症因子水平,效果与阳性对照环丙沙星相当。
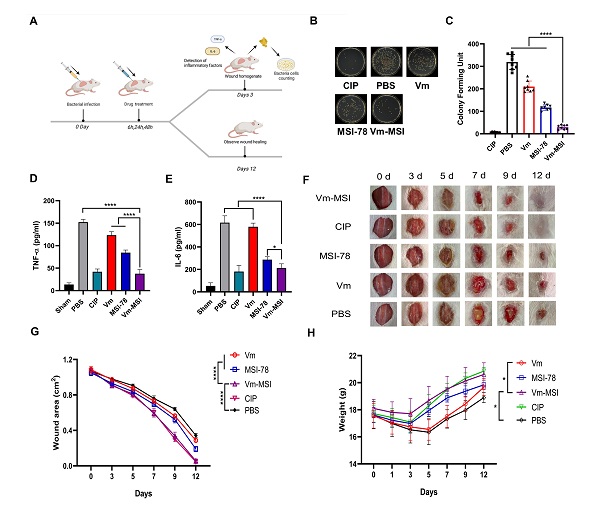
图3 Vm-MSI对VRSA诱导的小鼠皮肤感染具有良好的治疗效果
研究成果以“Vm-MSI,a vancomycin-antimicrobial peptide conjugate combating resistant bacteria and broadening antimicrobial spectrum”为题,发表于国际知名综合性期刊《Advanced Science》。论文第一作者为烟台海岸带所博士研究生李双宇、苏州大学硕士毕业生王慷和石文状,通讯作者为烟台海岸带所王义鹏研究员、苏州大学附属第二医院张鹏主任医师。苏州大学药学院李笃信教授和刘艳丽教授提供了大力帮助。本研究得到了国家自然科学基金、江苏省社会发展重点研发计划以及苏州市农业科技自主创新项目的资助。
成果信息:
Shuangyu Li,Kang Wang,Wenzhuang Shi,Xu Wang,Duxin Li,Yanli Liu,Peng Zhang,Yipeng Wang. 2025. Vm-MSI,a vancomycin-antimicrobial peptide conjugate combating resistant bacteria and broadening antimicrobial spectrum. Advanced Science,e03023. https://doi.org/10.1002/advs.202503023
附件下载: